¿Preparar o no a los especímenes biológicos para estudiarlos con el microscopio electrónico de barrido?

 Liderazgo Anáhuac en Innovación
Liderazgo Anáhuac en Innovación
La revista +Ciencia de la Facultad de Ingeniería nos comparte un interesante artículo sobre las maravillas ocultas a simple vista y que fueron reveladas con el advenimiento del microscopio electrónico.
La revista +Ciencia de la Facultad de Ingeniería nos comparte interesantes artículos como la creación de un generador de pulsos para uso en neurofisiología, la técnica de espectroscopía de dispersión de energía como auxiliar para conocer mejor los materiales o el microscopio electrónico de transmisión y la biología celular.
¿Preparar o no a los especímenes biológicos para estudiarlos con el microscopio electrónico de barrido?
La microscopía electrónica revela maravillas ocultas a simple vista, con electrones se crean imágenes magnificadas a partir de estructuras mili, micro y nanométricas, mostrando espectaculares detalles de la morfología celular y sobre todo de la textura de las superficies vistas a través del SEM.
Con el advenimiento del microscopio electrónico de barrido (SEM) en la segunda mitad del siglo XX, científicos de diversas disciplinas contribuyeron tanto al desarrollo de los mismos microscopios como a la búsqueda de métodos eficientes para resolver los inconvenientes que presentaban organismos y células para poder ser analizados en las exigentes condiciones de vacío de las columnas de los microscopios electrónicos. El estado de hidratación y el bajo número atómico de la composición química de la materia viva fueron, en un principio, grandes inconvenientes. En esa época, ambas configuraciones de los microscopios electrónicos de transmisión (TEM) y SEM se utilizaron como fuente de iluminación termo electrones originados en un filamento de tungsteno (W) calentado y sometido a una diferencia de potencial eléctrico para emitir electrones acelerados que, en algún momento de su trayectoria, entrarían en interacción con el material orgánico.
Algunas de las características que hacen diferente al SEM respecto del TEM en su diseño son: 1. Tiene una columna con lentes electromagnéticas, generalmente más corta y carece de lentes proyectoras; 2. La diferencia de potencial eléctrico tiene un máximo de 30 kilo electrón volts; 3. Una de las lentes está diseñada especialmente para producir que el haz de electrones se mueva con un desplazamiento cíclico y repetitivo, que recorre una superficie determinada línea por línea en un sistema de coordenadas (X, Y, Z).
La interacción entre el haz de electrones y la superficie del espécimen genera una zona de inestabilidad por colisiones llamada volumen de interacción de la que emergen dos tipos de señales: electrones y rayos X. La información que brindan esas señales es colectada por detectores específicos para cada señal producida (Reyes, 2019).
Si la muestra por analizar está libre de agua y su composición química está conformada por elementos de medio o alto número atómico, entonces quedaría libre de daño al interactuar con los electrones del haz principal. En otro caso, si la muestra es orgánica y sin preparación previa, al ser impactada por el haz de electrones se presentarían daños irreversibles en el espécimen, sin la posibilidad de obtener información morfológica ni de su composición química (Figura 1).
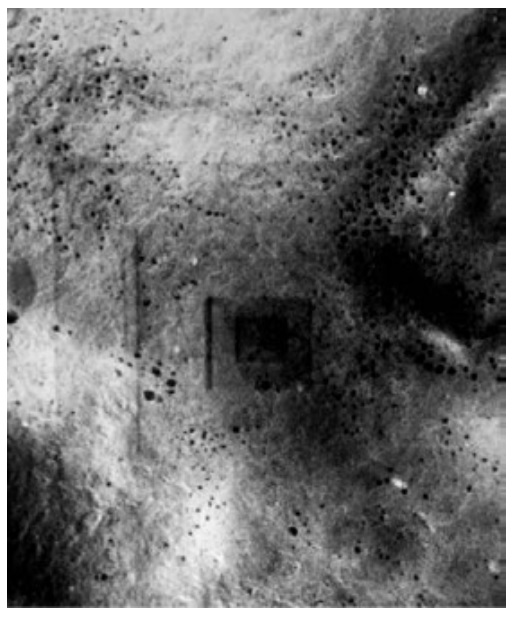
Figura 1. Imagen en que se observa el daño causado a un espécimen mal preparado para SEM.
Por todo lo expuesto anteriormente, la materia orgánica requiere de un intenso y minucioso protocolo para conferirle al espécimen estabilidad mediante la fijación, eliminar el estado líquido y conferirle conductividad eléctrica. Todas estas medidas están dirigidas a preservar sin alteraciones la morfología integral de los especímenes biológicos ante el impacto de los electrones, además de optimizar todos los beneficios que la microscopía electrónica de barrido ofrece (Figura 2).
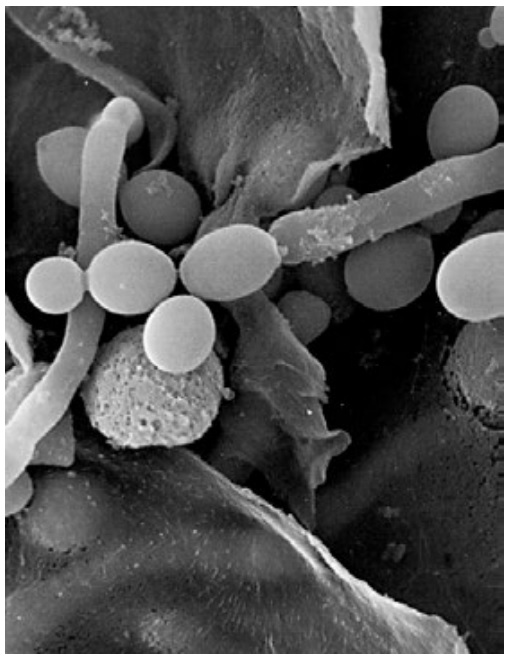
Figura 2. Esporas de Cándida sp. observada en SEM. Morfología característica de las esporas sin alteraciones morfológicas.
Actualmente es posible poner bajo el haz de electrones de un SEM todo tipo de material orgánico como son pequeñas muestras de animales, vegetales u órganos; tejidos, células y organelos celulares; hongos e incluso bacterias y virus, todos ellos con proporciones importantes de agua en su estructura.
El protocolo general a partir del cual se pueden procesar cualquiera de los materiales orgánicos antes mencionados es el siguiente:
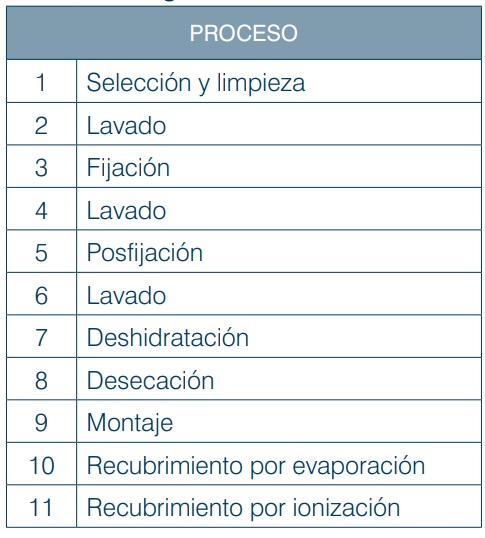
Tabla 1. Protocolo de preparación para especímenes biológicos
Todos y cada uno de los procesos mencionados en la tabla anterior son esenciales y determinantes para conseguir el objetivo de preparar especímenes biológicos con alto grado de calidad sin alterar la forma y las características propias de cada ejemplar procesado.
Antes de iniciar cualquier proyecto debemos recabar información fundamental respecto del material biológico con el que trabajaremos, como son las condiciones fisiológicas del entorno de ese material, pH y osmolaridad, entre otros, que servirán de referencia para preparar los reactivos que se utilizarán durante la técnica (Figura 3) con características semejantes a las de su entorno (Echlin, 2009).
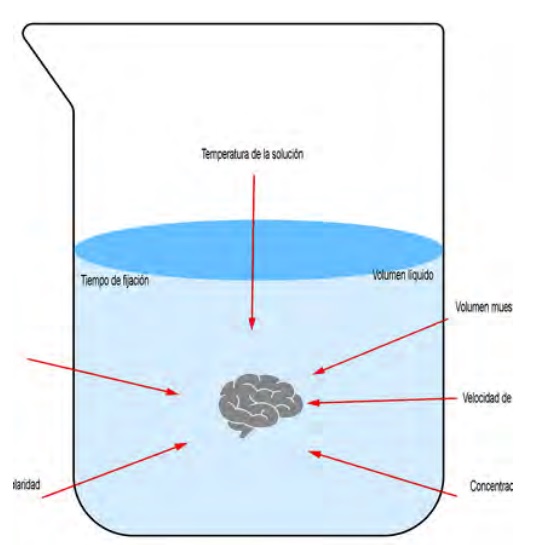
Figura 3. Representación de los factores más importantes para preservar el estado nativo de un espécimen biológico
Ahora revisaremos los puntos del proceso. En el punto número uno, se refiere a la selección del método de obtención de la muestra y eliminar todo aquello que esté sobre su superficie y que impida el contacto con los reactivos, mediante lavados, agitación amable o bien por sonicación e incluso por métodos enzimáticos.
El punto número dos del procedimiento, se aplica para eliminan todas las partículas y residuos de soluciones que quedaron del proceso anterior, utilizando un buffer o amortiguador isotónico con las características fisiológicas de la muestra. Punto tres, la fijación primaria es un proceso en el que se presenta una amplia gama de características y de variantes. Lo primero que hay que considerar como prioridad es que debe realizarse en el menor tiempo posible, debido a que cuando el espécimen vivo se aísla de sus condiciones vitales, se desencadenan procesos de autólisis. Los fijadores suspenden esos procesos autolíticos inmovilizando los componentes celulares para preservar el estado nativo de ese sistema biológico, además participan otros factores que determinan la eficiencia del fijador. En la Figura 3 se ejemplifica la participación de esos factores (Bozzola, 1999).
Punto cuatro, para eliminar los residuos de fijador se repite el lavado con solución amortiguadora como en el punto número dos. Punto cinco, de la posfijación, también conocida como fijación secundaria. El propósito de este proceso es estabilizar las membranas biológicas con tetra óxido de Osmio que tiene alta reactividad y afinidad por sus lípidos, después de cumplirse el tiempo de acción del segundo fijador, se pasa al punto número seis en el que se eliminan los residuos del osmio con lavados con el amortiguador inicial. Dada su alta volatilidad se recomienda utilizarlo bajo condiciones extremas de bioseguridad con equipo de protección como mascarillas de media cara o cara completa con cartuchos que filtren vapores orgánicos.
Respecto del punto siete, la deshidratación, el objetivo de este proceso es reducir la tensión superficial mediante el reemplazo del agua de la estructura biológica por un agente deshidratante como el etanol, cuando el agua haya sido sustituida por etanol absoluto, inmediatamente se pasa al siguiente proceso; punto ocho desecado por la técnica de Punto crítico, cuyo objetivo es reemplazar el etanol absoluto por bióxido de carbono (CO2) en estado líquido en condiciones controladas de temperatura y presión en un desecador de punto crítico, en este equipo el CO2 es llevado a sus constantes críticas (32 °C y 1072 PSI) en las que el CO2 cambia de su estado líquido a su estado gaseoso sin cambiar su densidad (Douglas, 2001). En una siguiente etapa, el gas contenido tanto en la muestra como en su entorno se liberará lentamente, cumpliendo el objetivo de eliminar todo vestigio de agua (tensión superficial cero) de la materia orgánica. Este método fue introducido por Anderson en 1970.
Para el punto nueve, los especímenes desecados se colocan sobre una platina de material no magnetizable (aluminio, bronce o carbono) adheridos con pegamento conductivo a base de carbono o plata. Finalmente, los puntos diez y once se refieren al proceso de recubrir la superficie de los especímenes con elementos químicos que sean buenos conductores eléctricos como el carbono, oro o bien aleaciones de oro-paladio u oro-platino.
Las evidencias de haber utilizado este protocolo a lo largo de la historia demuestran que es altamente confiable y, sobre todo, eficiente, conservando la morfología nativa de todo tipo de especímenes biológicos.
El desarrollo de técnicas de preparación evolucionó paralelamente con los avances tecnológicos de los microscopios, el tipo de filamentos, las mejoras en las lentes electromagnéticas y el tipo de detectores dieron resultados muy importantes en la magnificación y resolución, particularmente en los microscopios electrónicos de alto vacío (HVSEM).
El siguiente reto fue observar en los microscopios de barrido especímenes biológicos con cada vez menos preparación al material orgánico. A partir de la última década del siglo XX las compañías fabricantes de microscopios electrónicos hicieron modificaciones en los sistemas de vacío, así conocimos los microscopios de bajo vacío (LVSEM) y después lanzaron al mercado los microscopios conocidos como ambientales (ESEM), con presión en la cámara del espécimen muy cercana a la ambiental. Con todos estos esfuerzos, se han logrado observaciones de especímenes vivos y en medios líquidos, aunque solo por tiempos cortos y con resoluciones por debajo de las expectativas (Schatten, 2008).
Ya iniciado el siglo XXI, los fabricantes incorporaron nuevas tecnologías en las cámaras del espécimen de los microscopios como nuevos y múltiples detectores y micro manipuladores, además de un cañón de iones de Galio para manipular materiales no biológicos (microscopios de doble haz); sin embargo, cada vez se realizan más esfuerzos por aprovechar esos recursos en el trabajo con especímenes biológicos hidratados aunque hasta el momento los tiempos de observación en la cámara del espécimen son muy cortos, por lo que debemos esperar a que esta restricción pueda ser superada hasta obtener mejores resultados.
Por otro lado, para TEM se han desarrollado importantes avances tecnológicos para observar experimentos en material biológico in vivo y en tiempo real, expuestos al haz de electrones. Sin duda, en años próximos veremos importantes aplicaciones en los microscopios electrónicos de barrido.
*Autor: M. en C. Armando Zepeda Rodríguez, responsable del Laboratorio de Microscopía Electrónica de la Facultad de Ciencias (UNAM).
Referencias:
1. Bozzola, J. J. & Russell, L. D. (1999). Electron microscopy: Principles and techniques for biologists. 2nd ed. Jones and Bartlett Publisher.
2. https://doi.org/10.22201/ceiich.24485691e.2020.25.69610
3. Douglas, B. (2001). Critical Point Drying of Biological Specimens for Scanning Electron Microscopy. Methods in Biotechnology, vol. 13, Supercritical Fluid Methods and Protocols. Edited by: JR Williams and AA Clifford. Humana Press Inc.
4. Echlin, P. (2009). Handbook of sample preparation for scanning electron microscopy and X-Ray microanalysis. Springer Science.
5. Hawkes, P. W. & Spence, J. C. (2007). Science of Microscopy, vol. 1. Springer Science.
6. Reyes, G. J. Breve reseña histórica de la microscopía electrónica en México y en el mundo. Mundo Nano, 13 (25), 79-100.
7. Schatten, H., Pawley, J. B. (2008). Biological Low-Voltage Scanning Electron Microscopy. Springer Science.
8. An introduction to electron microscopy. (Published on Jul 15, 2010). FEI Co.
Da clic en la portada para conocer la revista completa

Para más artículos interesantes como este, te invitamos a consultar +Ciencia, la revista cuatrimestral de la Facultad de Ingeniería, que en cada número tiene contenido relevante de sus alumnos e investigadores. Da clic aquí para conocer todas las ediciones.
Más información:
+Ciencia. Revista de la Facultad de Ingeniería
Dra. María Elena Sánchez Vergara
elena.sanchez@anahuac.mx
